(NCT02157311: https://clinicaltrials.gov/ct2/show/NCT02157311)
Mise à jour du 19/07: Le premier à avoir publié le poster est le site d'actifsante.org. Il mène aussi vers la séquence Télé, sur TF1.
Voici un lien direct au poster. Un résumé a été présenté par thebody.com, mais pas de façon impartiale (appartient à une société commerciale de droit privé).
Le poster se télécharge aussi depuis la page: Dossier complet; il est recommandé de télécharger le ZIP, c'est plus simple. Le poster se trouve alors dans le répertoire: dossier_complet\Allegements\ICCARRE\Essais-cliniques\ANRS-162-4D
Ce qu'ANRS-4D a permis de découvrir
En Bref:
- que J. Leibowitch avait dit vrai: on peut suivre le 4/7, dans les règles
- Eviplera ® est éligible au 4/7
- on peut faire le 4/7 direct: sans passer par 6/7, 5/7
- il y a de la triche dans les essais
- il y a eu sabotage dans cet essai, non sponsorisé (voir ci-dessous)
- aucun échec intrinsèque dans cet essai
- pour les patients 100 % éligibles et 100% observants, les CV régulières n'ont rien appris: elles sont inutiles
- que les auteurs craignent de mettre en avant la rémission pharmaceutique, le gain économique et le potentiel dans les pays pauvres.
- le guide pratique avait des restrictions que l'on peut désormais lever.
Le sujet prête déjà à controverse! Et c'est à mourir de rire!
Pr. Philippe EVEN: Chaque essai clinique est un roman policier, c'est d'abord un roman parce qu'il est faux, et, il faut un esprit de policier pour détecter toutes les manoeuvres.
A la min. 53:30 de la vidéo d'Even.
Jacques Leibowitch fulmine, et il y a de quoi!
L'essai ANRS-4D refait, quasi à l'identique, l'essai de Garches (ICCARRE-1 et ICCARRE-2). Différence mineure: Eviplera® y est éligible (voir le descriptif). Et comme un essai est un test d'hypothèse, l'hypothèse testée est : "Leibowitch a-t-il menti?".
Si on refait, sans son instigateur, un essai, c'est pour s'assurer qu'il n'a pas menti. Si on avait fait confiance à toute l'équipe de Garches (Jacques Leibowitch, Dominique Mathez, Pierre de Truchis, Damien Ledu, Jean Claude Melchior, Christian Perronne, 6 employés de l'APHP...) on aurait pris pour argent comptant leurs résultats: pas d’échecs avec 94 patients. On trouve la même chose: on a la preuve que Leibowitch et al. n'ont pas menti... Ambiance!... Vous, vous ne saviez pas si les 6 de Garches avaient menti (hypothèse testée), mais, eux, ils savent la vérité: dur d'être ainsi mis à l'épreuve...
C'est le Pr. Perronne qui publie. On aura insinué qu'ils avaient triché, les 10 auteurs, donc on refait...
Et l'ANRS de dire: le résultat est encourageant (sic!). C'est se foutre du monde! Et d'annoncer 96 % de succès. Pas 100 % ... 96 ... Donc on l'aura compris, on insinue encore: Leibowitch aura menti à 4% près.
On va trainer ces 4 pseudo-échecs comme un boulet, parce que du coup, il faut refaire, en plus grand, pour être (enfin...) sûr de chez sûr... On s’intéressera donc à l'hypothèse testée dans Quatuor (si, si, on les attend là, aussi...)
Dans un compte-rendu d'essai on précise classiquement, au moins 2 types d'échecs: les échecs d'intention de traitement, et les échecs intrinsèques. Dans l’échec intention de traitement, on met tout: Monsieur est expatrié, il quitte la région et l'essai: échec; Madame angoisse et quitte l'essai : échec; Monsieur se suicide: échec. Madame interrompt son traitement (toxicité, etc.) : échec. Dans les échecs intrinsèques, on circonscrit aux seuls échecs raisonnablement imputable à la stratégie: on exclut les sorties pour convenance personnelle, et, quand on en a la preuve, on exclut les tricheurs!
Leibowitch, qui n'avait pas triché, va flairer la triche dans ANRS-162-4D. Il asticote de Truchis, qui va lâcher le morceau: il s'est fait avoir par 4 passagers clandestins.
Et l'ANRS de tomber dans le panneau.
Soit ils sont cons, soit ils sont méchants...ou les deux
Il débute l'essai et prend peur: Bravo le recrutement!
Moins de 4 semaines après le début de l'essai: Môssieur se sent mal, il angoisse, il prend peur, il abandonne.
On ne félicite pas le recrutement!
Imaginez que ce soit une cosmonaute... Un départ vers Mars ... De Truchis, ce n'est pas la NASA, et, heureusement!!!
On enrage... C'est quand même un essai qui ouvre la voie au traitement de millions de gens, en attente pour cause de pénurie! C'est plus important qu'un voyage sur la lune!
A l'évidence, un bon accompagnement des patients aiderait! Et maintenant qu'on connait les résultats de l'essai, on peut juger de la responsabilité de ceux qui diffusent la peur parmi les patients!
Cela nous rappelle l'importance du libre choix. Dans le guide pratique nous avions introduit le passage par 6/7, 5/7: c'est peut-être des étapes en trop. On notera toutefois que le passage progressif est favorable aux patients anxieux.
Monsieur: vous nous avez joué là un bien mauvais tour! Non seulement vous avez pris la place de patients motivés, qui n'ont pas pu être recruté faute de place, mais nous voilà contraint de refaire l'essai car votre abandon pèse sur l'image du protocole, que des millions de patients attendent!
Abandon (provisoire): ça ne compte pas!
Les 2 tricheurs: débusqués! par le dosage
Non au dopage! Non à la triche! Non aux tricheurs: le dosage vous met à jour ceux qui pissent bleu, et, aussi, ceux qui ne prennent pas leurs médocs du tout!
Le Figaro relève la triche:
«Parmi les 4 patients en échec, l'un a abandonné rapidement par peur, et deux n'ont vraisemblablement pas bien suivi leur traitement», explique Pierre de Truchis (hôpital Raymond-Poincaré), qui a conduit l'étude.
Oui, de Truchis a bel et bien accordé une interview! Il lâche le morceau ici:
Dr De Truchis: ... deux de ces trois avaient des dosages plasmatiques de médicaments bas qui laissent penser qu'ils ne prenaient pas tout à fait la dose attendue de médicaments
Il confirme d'ailleurs ici, lors d'IAS-2017
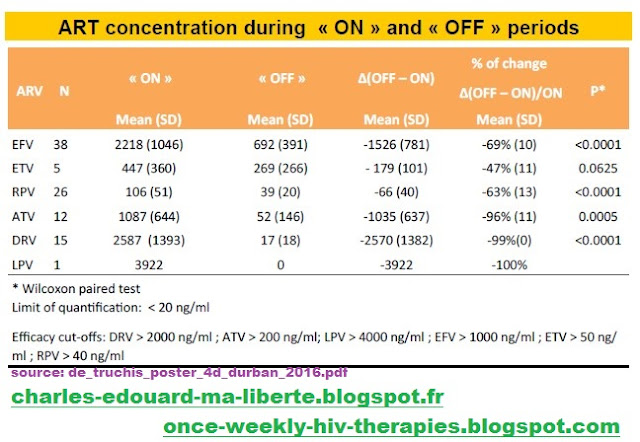
Qui sont les 2 patients en question? Identifier 2 patients sur 3, sur critère de dosage bas c'est facile... Puisque 1 des 3 patients a toujours un dosage largement discernable.
Le patient numéro 2 prend manifestement Atripla ®; il a une concentration d'Efavirenz en période ON bien au-dessus de la moyenne (3669 pour une moyenne, parmi les 100 patients de 2218) et en période OFF 1543 (pour une moyenne en OFF de 692), ce qui est même une concentration digne du ON. Si de Truchis compte ce patient comme celui qui ne prend pas ces médocs, il va falloir qu'il s'explique. Car, sur ce qu'il a publié, c'est bien le patient #2 qui prend ses médicaments correctement.
Qui sont donc ceux qui ne prennent pas la posologie commandée par l'essai ? A part #1 et #3 ? Qui ont effectivement des doses si faibles qu'on ne les détecte plus. Y compris en période où ils devaient prendre. Donc c'est clair.
Avoir des concentrations non détectables alors qu'on est censé prendre les médicaments et qu'on reporte une adhérence de 100 %, c'est mentir!
Madame, Monsieur: votre médecin vous a prescrit Kivexa + 1 inhibiteur de protéase, à prendre chaque jour, et vous sautez des prises ? On vous comprend !... Vous êtes dans un cercle vicieux: vous supportez mal les IP, vous sautez des prises, votre médecin s'en rend compte, craint la résistance, donc vous laisse sous IP. On comprend votre intérêt pour le cycle court. On comprend... Mais de là à mentir à l'investigateur... Votre mensonge nous coûte: relancer l'essai, différer le déploiement de la stratégie de 3, 4 voire 5 ans. Les millions de patients qui sont en attente d'une stratégie fiable ou plus simplement d'un traitement (pour cause de pénurie), ne vous disent pas merci! Là ce qui préjudiciable et condamnable c'est le mensonge.
Note pour les essais à venir: il ne fallait pas que les gens veuillent rentrer dans l’essai pour interrompre leur traitement. Ce devrait être le premier critère de non inclusion dans l’essai. Exclure quiconque voudrait rentrer dans l’essai pour arrêter son traitement.
On remercie toujours les volontaires... sauf les menteurs!
Triche (provisoire): ça ne compte pas!
Mais que fait là le clandestin ? Il est là grâce au saboteur ...
Et le Figaro de conclure: Ce qui ne laisse plus qu'un patient chez qui la stratégie a échoué à maintenir la charge virale indétectable.
Ah bon ??? Heureusement qu'on a compris, de longue date, que le Figaro est à la botte de BigPharma (sinon, comment ils auraient su que de Truchis allait/avait balancé, à Durban... Ils y étaient ?). En effet, il est dans l’intérêt des Labos de laisser croire qu'il y a des échecs intrinsèques, histoire d'entretenir la peur!
Le Figaro se prend les pieds dans le tapis. Relisons: Ce qui ne laisse plus qu'un patient chez qui la stratégie a échoué à maintenir la charge virale indétectable.
Le seul qui reste c'est le patient #2, sous Atripla®. On l'avait vu plus haut: il prend ses médicaments, ce n'est pas un tricheur, lui. Regardez bien... Il n'y a pas quelque chose qui vous choque? Regardez bien... Ça ne saute pas au nez, mais une fois qu'on l'a vu, on ne voit plus que cela.
Allez, une piste. Relisons le Figaro (journal scientifique, c'est bien connu): Ce qui ne laisse plus qu'un patient chez qui la stratégie a échoué à maintenir la charge virale indétectable.
Mais... Pour la maintenir indétectable, encore eut-t-il fallu qu'elle le fût, indétectable...
Le patient #2 a une CV quantifiable et quantifiée à 40 ! (pas une erreur d'imprimerie...)
On ne peut pas maintenir ce qu'on n'a pas. Mais quelle est la brêle qui laisse entrer dans un protocole ICCARRE un patient dont la virémie est faible mais détectable et surtout si près du disjoncteur : 50
Soit ils sont cons, soit ils sont méchants...ou les deux
S'agissant d'un essai ANRS, on penche un peu, maintenant, pour la troisième.
Quand on spécifie aux recruteurs: < 50 : cela signifie indétectable (avec seuil de détection au plus égal à 50). Jamais personne n'aurait idée d'inclure un patient avec une CV détectable...
ICCARRE sera médicalisé ou ne sera pas, dit Jacques Liebowitch. Eh bien, avec des brêles pareilles, c'est mal parti!
Monsieur: vous êtes un pion dans un jeu qui vous dépasse et une victime de la sur-médication, la mal-médication. Sous Atripla ® soit donc 7315 mg /semaine votre CV reste détectable (à 40). Vous voulez ICCARRE et, à 4180 mg/semaine, votre CV 'explose' à ... 55: donc on va quasi-doubler la dose de 4000 mg vous revoici à 7000 mg. Votre CV descend! À ... 47... 3000 mg/semaines pour 7 points de CV: 500 mg /semaine/point: vous reste une quarantaine de point... Vite qu'on augmente la dose! Une stratégie marche mal ? Qu'on double la mise. A ce rythme-là votre virologue va entrer au gouvernement de la France (ou à celui d'une boite pharmaceutique). Vous êtes mal parti: persévérez!
Erreur d'inclusion: ça ne compte pas!
Le saboteur est un pro !
Il n'y a pas erreur d'impression. Dans le poster il est écrit CV=40 et non pas CV < 40, et ce n'est pas une faute de frappe. Comment le sait-on ? A l'expérience (FAUCY, ICCARRE, BREATHER) on sait qu'une indétectabilité perdue se rattrape toujours par un simple retour en 7/7: pas d'exception connue. Si la CV du patient #2 avait été < 40, le seul retour à 7/7 (qu'il a repris, suite à la remontée de CV) suffit à retrouver l'indétectabilité. Oui, mais là, stricto sensu, il ne la retrouve pas: à S48, il est à CV = 47 (juste à 5 % en dessous de la barre, c'est trop drôle). Il ne retrouve pas l'indétectabilité parce qu'il ne l'avait pas: le CV = 40 est crédible.
C'est un patient dont la virémie fuit (tout en restant très faible): c'est rarissime, mais ça existe.
Et ça excite les virologues chevronnés!
Le patient a une virémie quantifiable et faible, au début (en 7/7...), puis une virémie quantifiable, 36 semaines après son retour officiel dans le 7/7. Si sa CV est détectable (mais faible) fin 2014 (en 7/7) et fin 2015 (en 7/7), que pensez-vous qu'elle ait été en 2013, 2012, 2011, 2010, 2009, années supposées d'indétectabilité continue ? Voyons, ne soyez pas naïf.
Un patient au profil si rare que dans une petite file active, d'un hôpital de province, il n'y en a probablement aucun... C'est très rare...
Ce patient-là, n'est pas dans l'essai par hasard: le virologue qui l'a inclus savait très bien que la moindre fluctuation d'une virémie qui fuit à 40 allait déclencher le dispositif qui est fixé à 50. Il suffit de refaire la mesure dans la foulée (9 jours après seulement), pour valider le déclenchement: et le tour est joué.
Et si ça n'avait pas marché à S12, il suffisait d'attendre, une autre opportunité serait revenue: ce coup était immanquable.
Théorie du complot? Paranoïa excessive? Vous n'arrivez pas à imaginer l'inimaginable? Pourtant c'est devant vos yeux, et, de Truchis, qui devra répondre aux questions lors de la publication aura vite fait de vous rassurer, si cette entrée clandestine est innocente. Sinon relisez les 3 autres échecs à l'aune de ce que le sabotage nous apprend. Le sabotage nous en apprend beaucoup sur la méthode, l'intention et l'auteur... Là, c'est décapant.
Nombre d’échecs intrinsèques: ZERO
On a envie de féliciter! Mais, féliciter qui? Les virologues recruteurs de l'ANRS?
De Truchis s'est-il fait savonner la planche? Suffit de regarder les centres recruteurs. Tiens, demandons à de Truchis de publier les centres de recrutement qu'on voit d'où viennent les 2 tricheurs et leurs 2 complices. Publier éviterait le soupçon. Car la présence des pieds nickelés de la virologie parisienne (Bichat, à l'évidence...) ça laisse jaser... S'il ne les publie pas, c'est qu'il les garde sous le coude: ça peut lui être utile.
Nombre d’échecs intrinsèques: ZERO
Nombre d’échecs intrinsèques: ZERO
Nombre d’échecs intrinsèques: ZERO
On ne le répétera jamais assez!
C'est la première étude à répondre de façon indubitable sur la question des échecs intrinsèques. Et, comme elle y répond, on peut relire les études précédentes avec comme grille de lecture qu'il n'y avait pas d’échec intrinsèque, donc ils étaient extrinsèques... ANRS-4D révolutionne le cycle court: des questions en suspens ont trouvé leur réponse; du coup il nous faut corriger le guide pratique en conséquence.
Les autres points à regarder
Pour éviter les redites, c'est commenté avec la traduction de chaque section du poster (voir ci-dessous). En bref:
- Pas de modification de l'ADN proviral (une mesure médiocre du réservoir): il fallait s'y attendre. Le 'réservoir' était en moyenne plutôt haut et souvent au-dessus des stupides critères Rouzioux
- Le foie apprécie
- le cholestérol: on s'en fout; il est innocent
- le gain en rémission pharmaceutique (et en coût) n'est pas explicité: c'est simple : environ 1/2 année par an et par patient (ce qui leur fait donc environ 1 an de rémission à fin 2016)
Le poster présenté à Durban 2016
Poster THPEB063: P. de Truchis (1), L. Assoumou (2), R. Landman (3), D. Mathez (4), J. Bellet (2), K. Amat (3), C. Katlama (5), P.M. Girard (6), D. Le Du (7), J. Izopet (8), B. Autran (9), M. Duracinski (10), J.C. Alvarez (11), D. Costagliola (2), C. Perronne (12) (1): APHP Hopital Raymond Poincare, CHU Paris Ile de France Ouest, Infectious Diseases, Garches, France, (2): Institut Pierre Louis Epidemiologie et Sante publique, INSERM, UPMC Universite
Paris 6, Paris, France, (3) IMEA, APHP CHU Bichat, Paris, France, (4) APHP CHU Paris Ile de France Ouest, Virology, Garches, France, 5APHP Hopital Pitie-Salpetriere, Universite Paris 06, Infectious Diseases, Paris, France, (6): APHP Hopital St Antoine, Universite Paris 06, Paris, France, (7) APHP Hopital R Poincare, Garches, France, 8CHU Toulouse, Hopital Purpan, Virology, Toulouse, France, (9) APHP Hopital Pitie-Salpetriere, Universite Paris 06, Immunology, Paris, France, (10) APHP CHU Bicetre, Paris, France, 11APHP Hopital R Poincare, Universite Versailles St Quentin, INSERM U1173, Pharmacology, Garches, France, (12) APHP Hopital R Poincare, Universite Versailles St Quentin, INSERM U1173, Infectious Diseases, Garches, France

Abstract
Background: Previous studies (FOTO, BREATHER) have given encouraging results with a 5/7 days Efavirenz-based maintenance regimen. Based on pilot experience (Leibowitch, FASEB .J. 2015), we conducted 48-week multicenter, open-label, single-arm prospective study evaluating efficacy and safety of 4/7 days maintenance therapy in HIV infected patients with controlled VL.
Methods: The main inclusion criteria were age > 18years; current regimen with 2 nucleoside analogs and either a boosted protease inhibitor PI/r or a NNRTI; no treatment modification in the last 6 months; VL < 50c/ml for at least one year; no resistance mutation to the drugs in the current regimen.
Maintenance therapy used the same regimen, taken 4 consecutive days of each week. Virological failure (VF) was defined as VL > 50c/ml confirmed within 4 weeks between D0-W48. Patients were evaluated at D0, W4, W8, W12, W16, W24, W32, W40, and W48. The study was designed to show that the efficacy of the strategy is superior to 80%, assuming a success rate equal to or above 90%, with a power of 87% and a 5% type-one error.
Values are presented as median [range]. Adherence to therapy was assessed by questionnaires, pill count, and MEMS caps for subgroup of patients.
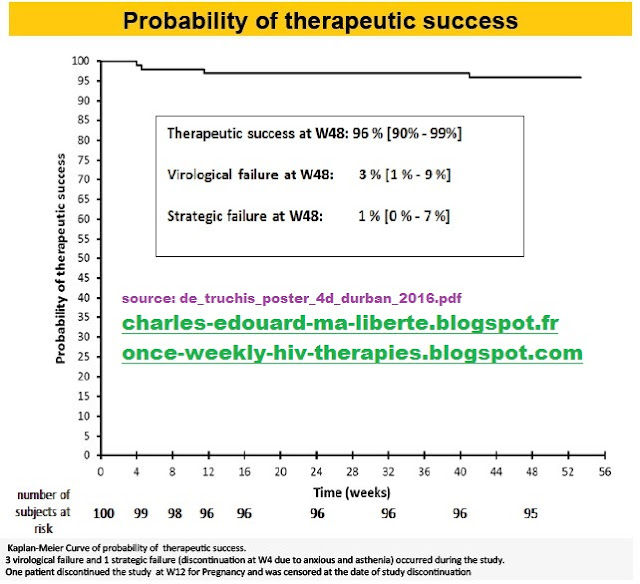
Results: One hundred patients were included in the study, 82 men and 18 women, median age 47 [25-75], CD4 nadir 282 [7-1044] cells/µl, and receiving ARV therapy since 5.1 [1.3-25.2] years with VL < 50 since 4.1 [0.5-15.5] years. Current regimen included Tenofovir: TDF+FTC (89 patients) or abacavir+3TC (11 patients), combined with a PI/r for 29 individuals (Lopinavir/r:1, Atazanavir/r:13, Darunavir/r:15) or a NNRTI for 71 (EFV: 41, RPV: 25, ETV: 5). After 48 weeks, 96% [95% CI 90-98, Kaplan-Meier estimate] were still under maintenance 4/7 days regimen without failure; 1 patient returned to 7/7 regimen and left the study at W4, VF was confirmed in 3/100 patients at W4, W8, W40, with VL785, 124, and 969c/ml respectively. These 3 patients returned to 7/7 regimen and VL was subsequently suppressed in all 3.
Conclusion: Over 48 weeks, maintenance ARV therapy with a 4days a week regimen was effective in these patients with suppressed VL under 2 nucleosides and either PI/r or NNRTI, resulting in success rate of 96%.

Background
Given the earlier recommended initiation of ART and the need for long life therapy, strategies reducing ART in take will have to be investigated for minimizing long-term cumulative toxicity of ARV drugs. A short cycle therapy strategy with planned short breaks from ART could be an alternative for reducing long-term toxic effects and costs. Previous studies (FOTO, BREATHER) have given encouraging results with a 5/7 days Efavirenz-based maintenance regimen.
Based on pilot experience (Leibowitch, FASEBJ-2015), we conducted a 48-week multicenter, open-label, single-arm prospective study evaluating efficacy and safety of a 4/7 days maintenance therapy in HIV infected patients with controlled VL.
Objective
The ANRS-162-4D study, short-cycle therapy strategy with 4-day on consecutively and 3-day off, aimed to evaluate the capacity of this strategy to maintain therapeutic success over 48 weeks in HIV-1-infected patients with controlled viral load for at least 12 months under antiretroviral treatment. Therapeutic success is defined by the absence of virologic failure (occurrence of two successive values of viral load > 50 copies/mL within 2 to 4 weeks apart), and the absence of study strategy discontinuation for more than 30 days.

Main inclusion criteria: age > 18years; current regimen with 2 nucleoside analogs and either a boosted protease inhibitor PI/r or NNRTI; no treatment modification in the last 4 months; plasma VL < 50c/ml for a least one year; no resistance mutation to the drugs in current regimen.
Patients were evaluated at D0, W4, W8, W12, W16, W24, W32, W40, W48 and W51.

Methods:
Primary endpoint: occurrence of therapeutic failure, as defined by 2 consecutive plasma viral load measurements > 50 copies/mL within two to four weeks, during the 48 weeks of follow-up (Virological failure) or discontinuation of the study/study strategy for more than 30 days (Strategic failure). ;
Secondary endpoints: tolerability, drug concentration, changes in CD4, CD4/CD8 ratio, metabolic parameters, and HIV DNA at week 48. For these secondary endpoints missing data were replaced by the last observation. Genotypic resistance test performed in patients in case of virological failure. ;
Adherence to the study strategy: assessed by self-reported questionnaires, pill count, drug concentrations, and MEMS caps for sub group of patients.
; Quality of life and felt symptoms: assessed by self-reported questionnaires a week 0, 24 and 48.
The study was designed to show that the efficacy of the strategy is superior to 80%, assuming a success rate equal to or above 90%, with power of 87% and 5% one-type error.
A maximum of 10 treatment failures including a maximum of 5 virological failures was expected over the study for success. The viral load monitoring was on line and the DSMB decision was required every two virological failures.

Study flowchart
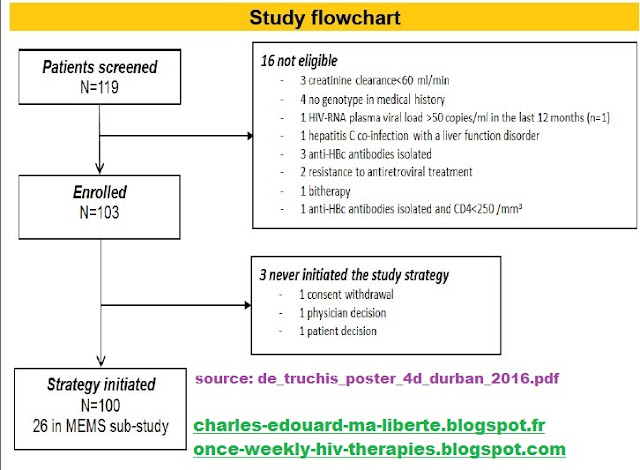
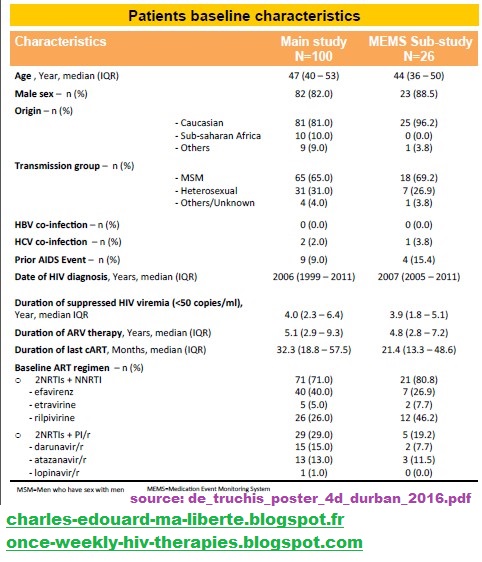
| Patients baseline characteristics | |||
| Characteristics |
Main study N=100 | MEMS Sub-study N=26 | |
| Age, Year, median (IQR) | 47 (40-53) | 44 (36-50) | |
| Male sex–n (%) | 82 (82.0) | 23 (88.5) | |
| Origin(%) | |||
| Caucasian | 81 (81.0) | 25 (96.2) | |
| Sub-saharan Africa | 10 (10.0) | 0 (0) | |
| Others | 9 (9.0) | 1 (3.8) | |
| Transmission group–n (%) | |||
| MSM | 65(65.0) | 25 (96.2) | |
| Heterosexual | 31 (31.0) | 7 (26.9) | |
| Others/Unknown | 9 (9.0) | 1 (3.8) | |
| HBV co-infection(%) | 0 (0.0) | 0 (0.0) | |
| HCV co-infection(%) | 2 (2.0) | 1 (3.8) | |
| Prior AIDS Event–n(%) | 9 (9.0) | 4 (15.4) | |
| Date of HIV diagnosis Years median (IQR) | 2006 (1999-2011) | 2007 (2005-2011) | |
| Duration of suppressed HIV viremia(< 50copies/ml), Year, median IQR | 4.0 (2.3 - 6.4) | 3.9(1.8 - 5.1) | |
| Duration of ARV therapy Years, median(IQR) | 5.1 (2.9-9.3) | 4.8 (2.8-7.2) | |
| Duration of last cART Months, median (IQR) | 32.3 (18.8-57.5) | 21.4 (13.3-48.6) | |
| Baseline ART regimen n (%) | |||
| o | 2NRTIs NNRTI | 71 (71.0) | 21 (80.8) |
| - Efavirenz | 40 (40.0) | 7 (26.7) | |
| - Etravirine | 5 (5.0) | 2 (7.7) | |
| - Rilpivirine | 26 (26.0) | 12 (46.2) | |
| o | 2NRTIsPI/r | 29 (29.0) | 5 (19.2) |
| - Darunavir/r | 15 (15.0) | 2 (7.7) | |
| - Atazanavir/r | 13 (13.0) | 3 (11.5) | |
| - Lopinavir/r | 1 (1.0) | 0 (0.0) | |
| MSM = Men who have sex with men; MEMS = Medication Event Monitoring System | |||
Over 48weeks,
Conclusion: maintenance ARV therapy with a 4 days a week regimen was effective in these patients with suppressed VL under 2 either PI/r or NNRTI, resulting in success rate of 96%. High adherence to therapy was assessed by questionnaires and MEMS caps. A comparative randomized trial and longer‐term follow‐up will further inform the real efficacy and sustainability of this strategy.

Patients with therapeutic failure N °c ART Age Sex CDC Duration of VL suppression (Year) pVL pre cART(cp/ml) CD4 Nadir (/mm3) CD4 (/mm3)pVL (cp/ml)ART concentration (ng/ml) Resistance Self reported Adherence DO W48 D0 failure W48 1st VL rebound VL Control 1 ABC 48 M C 6.7206811251119814<4027(S04) <40OFF3TC CTR (13 LPV:< 2 LPV/r days after): 785 2 TDF 5 2 M A 5.9310002095745474012(S12) 47 OFF FTC CTR ( 9days EFV: 1543 EFVa per): 55 study. OFF No 100% LPV:< 75RTV:< 10 ON No 100% TDF:71 FTC:207 EFV:3669 3 ABC 31 F A 4.2650042211361229< 2096(S40) <20 ON ON No 100% 3TC CTR (22 ATV:< 20 ATV: 4190ATV/r days aper):RTV: 1080227 4 TDF 35 M A 3.01498330500<20<20 OFF Discontinuation by ptat100% FTC(S04)EFV:709W04,related to the EFV study strategy




http://www.anrs.fr/VIH-SIDA/Clinique/Actualites/Allegement-therapeutique-La-piste-du-traitement-4-jours-7-progresse
Communiqué ANRS: tout bon -> annonce l'essai Quatuor
Allègement thérapeutique : La piste du traitement 4 jours/7 progresse
le 19/07/2016
Une trithérapie antirétrovirale de maintenance thérapeutique prise seulement 4 jours dans la semaine au lieu de 7 a permis de maintenir une charge virale inférieure à 50 copies chez 96 des 100 patients de l’étude ANRS 162-4D. Ces résultats sont présentés par le Dr Pierre de Truchis, hôpital Raymond Poincaré de Garches (AP-HP), lors de la 21ème Conférence internationale sur le SIDA (AIDS 2016), qui se tient à Durban en Afrique du Sud, du 18 au 22 Juillet. Ces résultats doivent être confirmés par un essai randomisé, de plus grande ampleur, et sur une plus longue période. L'essai ANRS QUATUOR démarrera à la fin 2016 avec cet objectif.
L’allègement thérapeutique est un enjeu important pour les patients vivant avec le VIH, dont le traitement antirétroviral doit être pris à vie. L'objectif est de réduire les effets secondaires, les coûts des traitements et d'améliorer l’acceptabilité et l’adhésion au traitement. Plusieurs essais ont cours actuellement dans le monde avec cet objectif. L'ANRS évalue ainsi l'intérêt de réduire les doses de médicaments, ou le nombre de prises ou encore d'épargner des classes de molécules. C'est ainsi que sont menés aujourd'hui en France l'essai ANRS 165 DARULIGHT, qui évalue le bénéfice d'une demi-dose de médicament (le Darunavir) par jour; l'essai ANRS 167 LAMIDOL l'intérêt d'une bithérapie Lamivudine-Dolutégravir, ou encore l'essai ANRS 163 ETRAL l'intérêt d'une autre bithérapie Etravirine-Raltegravir. L'essai ANRS 162-4D se situe, lui, dans la stratégie de réduire le nombre de prises. Les résultats sont présentés en poster par le Dr Pierre de Truchis (Hôpital Raymond Poincaré de Garches, AP-HP) lors de la 21ème Conférence internationale sur le SIDA (AIDS 2016), qui se tient du 18 au 22 Juillet, à Durban (Afrique du Sud).
L'essai ANRS 162–4D
L'étude ICCARRE, menée par le Pr Jacques Leibowitch (Service d'Infectiologie, Hôpital de Garches, AP-HP) a donné des résultats encourageants chez des patients suivis à Garches dont le traitement avait été réduit à 5 puis 4 jours par semaine, voire moins pour certains d’entre eux. (FASEB Journal, 2015).
Pour confirmer ces observations, l’ANRS a lancé en 2014 l’essai ANRS 162-4D. Cet essai prospectif non randomisé (tous les patients reçoivent le même schéma de traitement et ont été suivis 48 semaines), a été mené sous la responsabilité du Pr Christian Perronne (Hôpital de Garches, AP-HP). L'essai était multicentrique (mené dans plusieurs centres cliniques) et visait à évaluer l’efficacité du traitement antirétroviral pris 4 jours consécutifs sur 7 à maintenir, chez des patients VIH+ en succès thérapeutique, une charge virale inférieure à 50 copies/mL.
Les 100 patients inclus étaient traités par antirétroviraux en trithérapie depuis en moyenne cinq ans, et avaient une charge virale indétectable depuis quatre ans. Leurs combinaisons thérapeutiques comprenaient deux analogues nucléosidiques associés soit à un inhibiteur non nucléosidique de la transcriptase inverse soit à une anti-protéase.
Les résultats présentés à Durban sont encourageants. Après 48 semaines, en effet, 96% des patients suivaient toujours le schéma 4/7 jours, avec une charge virale inférieure à 50 copies. Seuls trois patients présentaient une charge virale de nouveau détectable à la 4e semaine de l'étude (S4), à S12 et S40 (respectivement 785 cp/mL, 124 cp/mL et 969 cp/mL). Chez ces patients, la charge virale est redescendue sous le seuil de détection avec le retour à un schéma de traitement 7/7jours et cela sans apparition de résistances. Un patient a abandonné l’étude de sa propre initiative à S4.
Ces données sont complétées par une analyse concomitante de l’observance thérapeutique basée sur des auto-questionnaires, sur des dosages sanguins des médicaments, et sur le comptage des prises grâce à des piluliers électroniques dans un sous-groupe de patients. « L’analyse des études d’observance a montré que le programme 4/7 jours a été très bien suivi et accepté par les patients. Dans plus de 90% des cas, la prise est conforme à la prescription », commente le Dr Pierre de Truchis.
Cette stratégie innovante doit être maintenant validée dans un essai randomisé où deux groupes de patients vont pouvoir être comparés. C'est l'objet de l’essai ANRS QUATUOR qui va être mené chez un plus grand nombre de patients, sur une plus longue période et avec des antirétroviraux plus récents comme la classe des anti-intégrases qui occupe désormais une place prépondérante dans l’arsenal thérapeutique. 640 patients devraient être recrutés dans plusieurs centres hospitaliers, dont la moitié recevra pendant 48 semaines un traitement 4/7 jours et l'autre moitié 7/7 jours. Si des résultats similaires étaient observés dans les deux groupes, tous les patients de l’essai passeraient au traitement 4/7 jours pendant 48 semaines supplémentaires. L'essai cherchera à démontrer que la stratégie 4/7 jours est non-inférieure à la stratégie continue, en d'autres termes qu'à efficacité égale, les patients du groupe "Allègement" retireront des bénéfices secondaires de ce protocole (moins d'effets secondaires, meilleure observance …).
Selon le Pr Jean-François Delfraissy, Directeur de l'ANRS « Ces résultats nous encouragent à poursuivre nos objectifs d'améliorer la qualité de vie sous traitement et à répondre à une demande forte de certains patients de subir une moindre pression médicamenteuse ». Faut-il aujourd'hui recommander 4/7 jours en pratique courante ? « Seul un essai randomisé permettra d'approuver cette stratégie », ajoute-t-il. Rappelons que les actuelles recommandations internationales sont d'initier un traitement le plus tôt possible après la découverte de la séropositivité, quel que soit le niveau des lymphocytes CD4, et ce, de manière continue.
descriptif officiel de l'essai ANRS-162-4D
Le document original est ici. et ici une copie de secours
ANRS 162 4D
Essai clinique évaluant la capacité à maintenir le succès virologique d’une stratégie de prise de traitement antirétroviral 4 jours consécutifs sur 7 en relais d’une stratégie à 7 jours sur 7 chez des patients infectés par le VIH-1 ayant une charge virale VIH-1 indétectable depuis au moins 12 mois
Promoteur: Inserm-ANRS
Nombre de centres: 17
Début des inclusions 3ème trimestre 2014
Equipe de coordination Investigateur coordonnateur C. Perronne (Hôpital Raymond Poincaré, Garches) Virologie-Immunologie D. Mathez (Hôpital Raymond Poincaré, Garches)
Pharmacologie J-C. Alvarez et E Abe (Hôpital Raymond Poincaré, Garches)
Méthodologie, statistique D. Costagliola (CMG de l’Inserm UMR S 1136, Paris)
Monitorage R. Landman (IMEA Consulting S.A.S., hôpital Bichat, Paris)
Chef de projet K. Amat et A. Benalycherif (IMEA Consulting S.A.S., hôpital Bichat, Paris)
Objectifs Principal: Cet essai a pour objectif principal d’évaluer à 48 semaines, la capacité à maintenir le succès thérapeutique, d’une stratégie d’un traitement antirétroviral 4 jours consécutifs sur 7 jours, chez des patients infectés par le VIH-1 ayant une charge virale indétectable depuis au moins 12 mois, en traitement de suite d'un même traitement pris depuis au moins 4 mois. Le succès thérapeutique est défini par l’absence d’échec virologique (survenue de deux valeurs successives de charge virale > 50 copies/mL dans un délai de 2 à 4 semaines d’intervalle), et l’absence d’arrêt de la stratégie thérapeutique (interruption ou modification de la stratégie 4 jours sur 7 sur une durée supérieure à 30 jours)
Secondaires : Evaluation du succès virologique à S48 ; Evaluation du délai d’apparition d’un échec virologique ; Evaluation du nombre de blips; Evaluation du nombre de charges virales faibles (comprises entre 20 et 50 copies/mL) ; Evaluation des charges virales avec ou sans signal détectable lorsque celles-ci ne sont pas quantifiables ; Etude du profil des mutations de résistance apparues au cours de l’essai en cas d’échec virologique ; Etude de l’évolution des lymphocytes CD4 et CD8, du rapport CD4/CD8 de J0 à S48 ; Etude de l’évolution de l’ADN VIH dans les PBMC ; Etude des événements cliniques liés au VIH selon la classification CDC ; Etude de l’incidence des effets indésirables cliniques et biologiques ; Etude des arrêts de la stratégie de l’essai (interruption ou modification de la stratégie 4 jours sur 7 pour une durée supérieure à 30 jours) et le délai de cet arrêt ; Etude de l’évolution de la fonction rénale, de la fonction hépatique, et des paramètres glucido-lipidiques de J0 à S48 ; Etude de l’évolution des marqueurs d’activation immunitaire et d’inflammation ; Etude des dosages pharmacologiques résiduels du 3ème agent antirétroviral (inhibiteur de protéase ou inhibiteur non nucléosidique de la transcriptase inverse) ; Etude de la qualité de vie des participants et de l’observance des participants.
Méthodologie Essai ouvert, multicentrique national, prospectif, non randomisé.
Durée de l’essai Inclusions : 12 mois – Suivi par patient : 51 semaines.
Sous étude « évaluation de l’observance par MEMS » : 30 patients.
Sujets à inclure Patient(e) ayant une infection par le VIH-1 documentée, quel que soit le sous-type ; Age supérieur ou égal à 18 ans ; Charge virale VIH-1 plasmatique inférieure ou égale à 50 copies/mL depuis au moins 12 mois sur tous les prélèvements (au minimum 3 prélèvements, incluant celui de la pré-inclusion, doivent avoir été réalisés sur les 12 derniers mois) ; Lymphocytes CD4 > 250/mm3, depuis au moins 6 mois ; Patient(e) recevant depuis au moins 4 mois un même traitement antirétroviral associant 2 inhibiteurs nucléosidiques/nucléotidiques de la transcriptase inverse (INTI) avec, soit 1 inhibiteur non nucléosidique de la transcriptase inverse (INNTI), soit 1 inhibiteur de protéase boosté par du ritonavir (IP/r). La liste des antirétroviraux acceptés est restrictive : pour les INTI : ténofovir, emtricitabine, abacavir, lamivudine, pour les IP/r : lopinavir/r, darunavir/r ou atazanavir/r, pour les INNTI : efavirenz, rilpivirine ou etravirine ;Trithérapie antirétrovirale exclusive (pas de quadrithérapie antirétrovirale) ; Au moins un génotype (séquence d’acides aminés de la transcriptase inverse et/ou de la protéase selon les molécules en cours) doit être disponible dans l'historique du patient; le virus doit être sensible à toutes les molécules antirétrovirales en cours, sur tous les génotypes disponibles ; Test de grossesse négatif pour la femme en âge de procréer et utilisation d’une contraception mécanique lors des rapports sexuels.
Critères d'évaluation Principal : Le critère de jugement principal est le succès thérapeutique jusqu’à la 48ème semaine. Le succès thérapeutique est défini par l'absence d’échec virologique, et l'absence d'arrêt de la stratégie thérapeutique de l'essai. L'échec virologique est défini par une charge virale > 50 copies/mL confirmée par une seconde mesure faite dans un délai de 2 à 4 semaines. La stratégie thérapeutique de l'essai est le traitement antirétroviral intermittent pris 4 jours consécutifs fixes par semaine. L’arrêt de la stratégie de l'essai est défini par toute interruption ou modification de la stratégie 4 jours sur 7 pour une durée supérieure à 30 jours.
Secondaires : Etude de la proportion de participants en succès virologique jusqu'à S48 ; Etude du délai de survenue de l’échec virologique ; Evaluation du pourcentage de participants présentant un "blip" (charge virale supérieure à 50 copies/mL avec un contrôle réalisé entre 2 à 4 semaines plus tard inférieur ou égal à 50 copies/mL) ; Evaluation du pourcentage de participants présentant une charge virale faible (charge virale comprise entre 20 et 50 copies/mL) ; Evaluation des charges virales avec ou sans signal détectable lorsque celles-ci ne sont pas quantifiables ; Etude du profil des mutations de résistance apparues en cours d’essai ; Etude de l’évolution des lymphocytes CD4 et CD8, et du rapport CD4/CD8 de J0 à S48 ; Etude de l’évolution de l’ADN VIH dans les PBMC de J0 à S48 ; Etude des événements cliniques liés au VIH selon la classification CDC, et évaluation des EIG ; Etude de l’incidence des effets indésirables cliniques et biologiques ; Etude de la proportion des participants arrêtant la stratégie thérapeutique de l’essai (interruption ou modification de la stratégie 4 jours sur 7 sur une durée supérieure à 30 jours) et le délai de cet arrêt, Etude de l'évolution de la fonction rénale, de la fonction hépatique, et du métabolisme glucido-lipidique de J0 à S48 ; Etude de l’évolution des marqueurs d’activation immunitaire et d'inflammation ; Etude des concentrations plasmatiques des antirétroviraux en résiduel (3ème agent) ; Etude de la qualité de vie et de l’observance aux traitements antirétroviraux (questionnaires, carnet d'auto-surveillance, dosages plasmatiques, sous-étude « évaluation de l’observance par MEMS ». Sujets inclus / espérés 100/100 et pour la sous – étude : 29/30. Traitement Une association de 2 INTI associés à 1 INNTI ou 1 IP/r, à choisir entre : INTI = ténofovir, emtricitabine, abacavir, lamivudine, INNTI = efavirenz, rilpivirine ou étravirine, IP boostée = lopinavir/r, darunavir/r, atazanavir/r.
Dernière version du protocole version 1.0 du 28/01/2014.
Pour information
| Christian Perronne | Dominique Costagliola |
| Département de médecine aiguë spécialisée | Unité 1136 Inserm, Faculté de Médecine |
| Hôpitaux Universitaires Paris IdF Ouest | Université Pierre et Marie Curie |
| Hôpital Poincaré-104 Bd Raymond Poincaré | 56 Bd Vincent Auriol, BP 335 |
| 92380 Garches 75625 | Paris cedex 13 |
| Tél. : 01 47 10 77 58 | Tél. : 01 42 16 42 82 |
| Fax : 01 47 10 77 67 | Fax : 01 42 16 42 61 |
| c.perrone... suivi de l'arobase puis de ... rpc.aphp.fr | dominique.costagliola... suivi de l'arobase puis de ...upmc.fr |





Aucun commentaire:
Enregistrer un commentaire
N'hésitez pas à discuter ici. Merci de prendre un pseudo histoire qu'on s'y retrouve et qu'on sympatise. Dans 'sélectionner votre profil', choisissez Nom/URL et ne remplissez que la case nom avec votre pseudo.
Pour me communiquer votre adresse email, laissez-la dans un commentaire de billet 'ancien' (plus d'un an): votre commentaire sera intercepté et votre mail pas publié. Pensez à partager le blog sur les réseaux sociaux. Merci